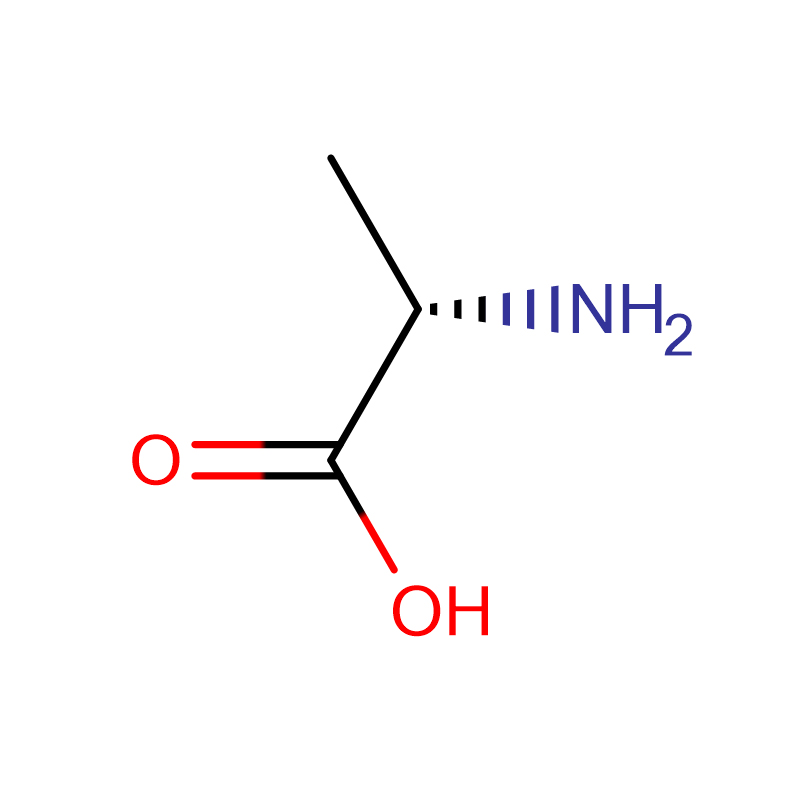
L-alanina CAS: 56-41-7 99% Polvo cristalino blanco
| Numero de catalogo | XD90326 |
| nombre del producto | D-alanina |
| CAS | 338-69-2 |
| Fórmula molecular | C3H7NO2 |
| Peso molecular | 89.09 |
| Detalles de almacenamiento | Ambiente |
| Código Arancelario Armonizado | 29224985 |
Especificaciones del producto
| Apariencia | polvo cristalino blanco |
| Ensayo | 98,5 - 101,5% |
| Rotacion especifica | +13,7 a +15,1 |
| Metales pesados | <0.0015% |
| pH | 5.5 - 7 |
| SO4 | <0.03% |
| Pérdida por secado | <0.2% |
| Hierro | <0.003% |
| Residuos en ignición | <0.15% |
| Tamaño de partícula | 200um |
| Cl | <0.05% |
| Nivel de contaminantes orgánicos persistentes | Sin contaminantes |
Las γ-glutamiltranspeptidasas (γ-GT) escinden el enlace γ-glutamilamida del glutatión y transfieren el grupo γ-glutamil liberado al agua (hidrólisis) o a los aminoácidos aceptores (transpeptidación).Estas enzimas ubicuas juegan un papel clave en la biosíntesis y degradación del glutatión y en la desintoxicación de xenobióticos.Aquí informamos la estructura cristalina de resolución 3Å de Bacillus licheniformis γ-GT (BlGT) y la de su complejo con l-Glu.Las estructuras de rayos X confirman que BlGT pertenece a la superfamilia de hidrolasas nucleófilas N-terminales y revelan que la proteína posee una hendidura de sitio activo abierta similar a la reportada para la enzima homóloga de Bacillus subtilis, pero diferente de las observadas para γ-GT humana y para γ-GTs de otros microorganismos.Los datos sugieren que la unión de l-Glu induce un reordenamiento de la cola C-terminal de la subunidad grande de BlGT y permite la identificación de un grupo de residuos ácidos que están potencialmente involucrados en el reconocimiento de un ion metálico.El papel de estos residuos en la estabilidad conformacional de BlGT se ha estudiado mediante la caracterización del autoprocesamiento, la actividad enzimática, la desnaturalización química y térmica de cuatro nuevos mutantes simples de Ala.Los resultados muestran que la sustitución de Asp568 por Ala afecta tanto al autoprocesamiento como a la estabilidad estructural de la proteína.