GSH Cas: 70-18-8 98% Polvo cristalino blanco
| Numero de catalogo | XD90227 |
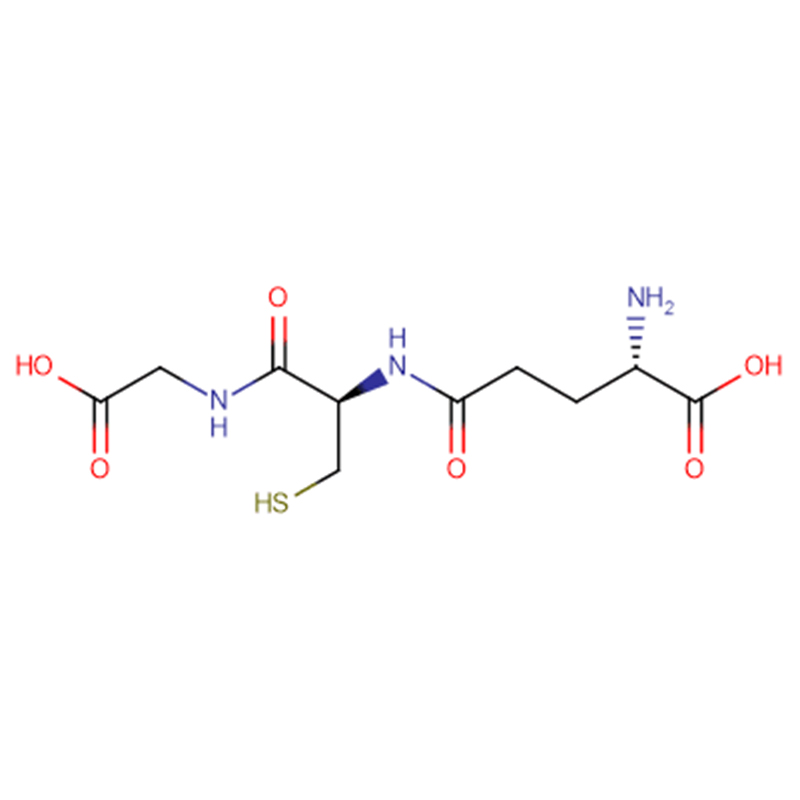
| nombre del producto | GSH |
| CAS | 70-18-8 |
| Fórmula molecular | C10H17N3O6S |
| Peso molecular | 307.323 |
| Detalles de almacenamiento | 2 a 8 °C |
| Código Arancelario Armonizado | 29309098 |
Especificaciones del producto
| Especificaciones del producto | |
| Punto de fusion | 185°C |
| Calificación | Grado farmacéutico |
| Metales pesados | 10 ppm máx. |
| Arsénico | 2 ppm máx. |
| Identificación | IR: similar al espectro de referencia |
| Pérdida por secado | 0,5 % máx. |
| Temperatura de almacenamiento | +20 °C |
| Peso molecular | 612.63 |
| Ensayo | 98,0% mín. |
| Rotación óptica | -15,5°- -17,5 grados |
| Residuos en ignición | 0,1% máx. |
| Claridad de la solución | Claro e incoloro |
| Apariencia | polvo cristalino blanco |
| Sustancia relacionada | Total: 2,0 % máx., GSSG: 1,5 % máx. |
La proteína ORF45 del herpesvirus asociado al sarcoma de Kaposi (KSHV) es una proteína del tegumento inmediato temprano específica del gammaherpesvirus.Nuestros estudios anteriores han revelado su papel crucial en las etapas temprana y tardía de la infección por KSHV.En este estudio, examinamos el interactoma de ORF45 utilizando un panel de anticuerpos monoclonales.Además de las proteínas quinasa regulada extracelular (ERK) y p90 ribosomal S6 quinasa (RSK) previamente identificadas, encontramos varias otras proteínas copurificadas, incluidas las prominentes de ∼38 kDa y ∼130 kDa.La espectrometría de masas reveló que la proteína de 38 kDa es ORF33 viral y la proteína de 130 kDa es USP7 celular (proteasa 7 específica de ubiquitina).Asignamos el dominio de unión a ORF33 a los 19 aminoácidos (aa) carboxilo-terminales altamente conservados de ORF45 y el dominio de unión a USP7 al motivo de consenso informado en la región central de ORF45.Usando la tinción de inmunofluorescencia, observamos la colocalización de ORF45 con ORF33 o USP7 tanto en condiciones transfectadas como en células infectadas con KSHV.Además, notamos la relocalización dependiente de ORF45 de una porción de ORF33/USP7 del núcleo al citoplasma.Descubrimos que ORF45 provocó un aumento en la acumulación de proteína ORF33 que se eliminó si se eliminaba el dominio de unión a ORF33 o USP7 en ORF45.Además, la eliminación del término carboxilo conservado de ORF45 en el genoma de KSHV redujo drásticamente el nivel de proteína ORF33 en células infectadas con KSHV y eliminó la producción de viriones de progenie.En conjunto, nuestros resultados no solo revelan nuevos componentes del interactoma ORF45, sino que también demuestran que las interacciones entre estas proteínas son cruciales para la replicación lítica del KSHV. El herpesvirus asociado al sarcoma de Kaposi (KSHV) es el agente causal de varios cánceres humanos.KSHV ORF45 es una proteína multifuncional que se requiere para la replicación lítica de KSHV, pero los mecanismos exactos por los cuales ORF45 realiza sus funciones críticas no están claros.Nuestros estudios previos revelaron que toda la proteína ORF45 en las células existe en complejos de alto peso molecular.Por lo tanto, buscamos caracterizar el interactoma de ORF45 para proporcionar información sobre sus funciones durante la replicación lítica.Usando un panel de anticuerpos monoclonales, examinamos el interactoma ORF45 en células infectadas con KSHV.Identificamos dos nuevos socios de unión de ORF45: la proteína viral ORF33 y la proteasa 7 específica de ubiquitina celular (USP7).Además, demostramos que la interacción entre ORF45 y ORF33 es crucial para la producción eficiente de partículas virales de KSHV, lo que sugiere que la interferencia dirigida con esta interacción puede representar una nueva estrategia para inhibir la replicación lítica de KSHV.