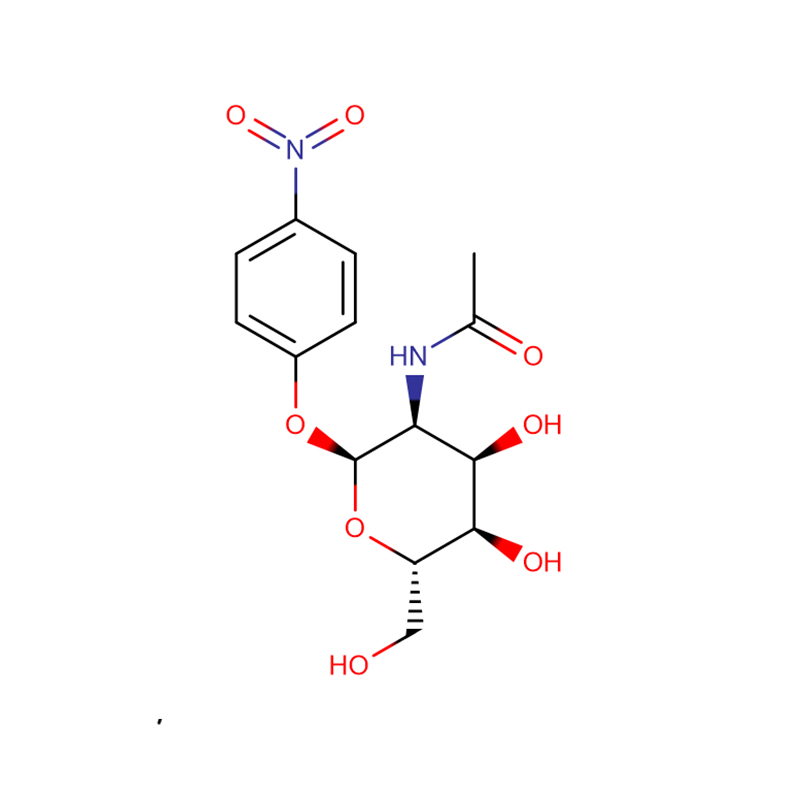
p-Nitrofenil -aL-Fucopyranoside Cas: 10231-84-2 Polvo cristalino blanco a amarillo pálido
| Numero de catalogo | XD90142 |
| nombre del producto | p-Nitrofenil -aL-Fucopyranósido |
| CAS | 10231-84-2 |
| Fórmula molecular | C12H15NO7 |
| Peso molecular | 285.25 |
| Detalles de almacenamiento | 2 a 8 °C |
| Código Arancelario Armonizado | 29400000 |
Especificaciones del producto
| Apariencia | Polvo cristalino de color blanco a amarillo pálido |
| Asay | 99% |
| TLC | Punto único |
| Pureza HPLC | Mínimo 98% |
| Solubilidad (1 % en agua) | Solución transparente e incolora |
| Densidad | 1,503±0,06 g/cm3 (20 ºC 760 Torr), |
| Punto de fusion | 196-197 ºC |
| Punto de ebullición | 515,4°Cat760mmHg |
| punto de inflamabilidad | 265,5°C |
| Índice de refracción | 1.623 |
LecA (PA-IL) es una lectina y adhesina citotóxica producida por Pseudomonas aeruginosa que se une a galactósidos hidrofóbicos con alta especificidad y afinidad.Mediante el uso de una fusión de traducción lecA-egfp y un análisis de inmunotransferencia de la matriz extracelular de biopelícula, mostramos que lecA se expresa en células cultivadas en biopelícula.En ensayos estáticos de biopelícula tanto en poliestireno como en acero inoxidable, la profundidad de la biopelícula y la cobertura de la superficie se redujeron por la mutación de lecA y se mejoraron en la cepa PAO-P47 que sobreproduce LecA.El crecimiento en presencia de isopropil-beta-D-tiogalactósido (IPTG) o p-nitrofenil-alfa-D-galactósido ( GNP).Además, las biopelículas maduras de tipo salvaje formadas en ausencia de estos galactósidos hidrofóbicos podrían dispersarse mediante la adición de IPTG.Por el contrario, la adición de p-nitrofenil-alfa-L-fucosa (NPF), que tiene una alta afinidad por la lectina LecB (PA-IIL) de P. aeruginosa, no tuvo efecto sobre la formación o dispersión de biopelículas.El crecimiento planctónico de P. aeruginosa PAO1 no se vio afectado por la presencia de IPTG, NPG o NPF, y la cepa tampoco pudo utilizar estos azúcares como fuentes de carbono, lo que sugiere que los efectos observados en la formación de biopelículas se debieron a la inhibición competitiva del ligando LecA. vinculante.También se obtuvieron resultados similares para biopelículas cultivadas en condiciones de flujo dinámico en cupones de acero, lo que sugiere que LecA contribuye a la arquitectura de biopelículas de P. aeruginosa en diferentes condiciones ambientales.
Se ha detectado una alfa-L-fucosidasa (EC 3.2.1.51) capaz de liberar el residuo t-fucosil de la cadena lateral de los oligosacáridos de xiloglucano en las hojas de las plantas de Arabidopsis.Además, se purificó una alfa-L-fucosidasa con una especificidad de sustrato similar a partir de hojas de col (Brassica oleracea) para producir una sola banda en SDS-PAGE.Se obtuvieron dos secuencias peptídicas de esta banda de proteína, y se usaron para identificar un gen de Arabidopsis que codifica una alfa-fucosidasa que proponemos llamar AtFXG1.Además, también se ha encontrado un gen de Arabidopsis con homología con alfa-L-fucosidasas conocidas, y propusimos nombrarlo como AtFUC1.Tanto AtFXG1 como ATFUC1 se expresaron heterólogamente en células de Pichia pastoris y las actividades de alfa-L-fucosidasa se secretaron al medio de cultivo.La alfa-L-fucosidasa codificada por AtFXG1 fue activa frente a los oligosacáridos del xiloglucano XXFG, así como frente al 2'-fucosil-lactitol pero no frente al p-nitrofenil-alfa-L-fucopiranósido.Sin embargo, el AtFUC1 heterólogamente expresado fue activo solo contra 2'-fucosil-lactitol.Por lo tanto, el primero debe estar relacionado con el metabolismo de los xiloglucanos.