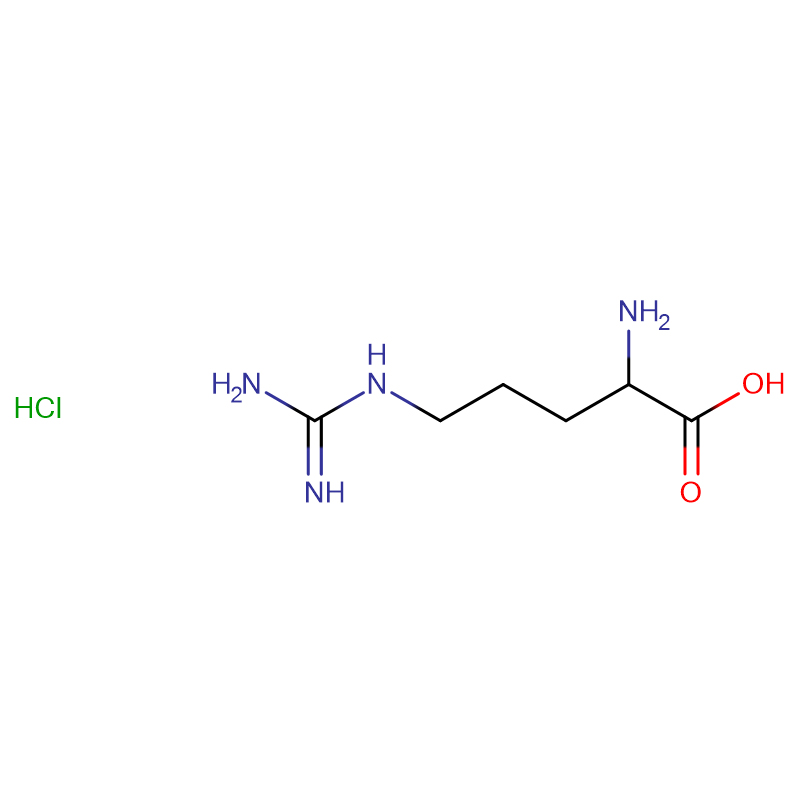
L-Arginina CAS:74-79-3 99% Cristales blancos o polvo cristalino
| Numero de catalogo | XD90323 |
| nombre del producto | L-arginina |
| CAS | 74-79-3 |
| Fórmula molecular | C6H14N4O2 |
| Peso molecular | 174.20 |
| Detalles de almacenamiento | Ambiente |
| Código Arancelario Armonizado | 29252900 |
Especificaciones del producto
| Apariencia | Cristales blancos o polvo cristalino |
| Ensayo | 99% |
| Identificación | Absorción de infrarrojos |
| Pérdida por secado | ≤ 0,5% |
| Pureza cromatográfica | No se encuentra más del 0,5 % de cualquier impureza individual ; No se encuentra más del 2,0 % del total de impurezas |
| Residuos en ignición | ≤ 0,3% |
| Metales pesados (PB) | ≤ 0.0015% |
| Hierro (como Fe) | ≤ 0,003 % |
| Sulfato (como SO4) | ≤ 0,03% |
| grado usp | USP 33 |
| Cloruro (CI) | ≤ 0,05% |
| Rotación específica [ α ] D 2 5 | +26,3 ° ~ +27,7 ° |
El mecanismo de Mycobacterium smegmatis G (MbsG), una l-lisina monooxigenasa dependiente de flavina, se investigó en condiciones de reacción rápida y de estado estacionario utilizando efectos de isótopos cinéticos primarios y solventes, análogos de sustrato, pH y efectos de viscosidad del solvente como sondas mecánicas.Los resultados sugieren que la l-lisina se une antes que la NAD(P)H, lo que conduce a una disminución de la constante de velocidad para la reducción de la flavina.La unión de l-lisina no tiene efecto sobre la tasa de oxidación de la flavina, que ocurre en un proceso de un solo paso sin la observación de un intermedio C4a-hidroperoxiflavina.Se determinaron efectos similares con varios sustratos análogos.La oxidación de flavina es independiente del pH, mientras que los perfiles de pH kcat/Km y kred/KD para NAD(P)H exhiben valores de pKa únicos de ~6,0, con una actividad creciente a medida que disminuye el pH.A un pH más bajo, la enzima se desacopla más, produciendo más peróxido de hidrógeno y superóxido.La transferencia de hidruro es parcialmente limitante de la velocidad a pH neutro y se vuelve más limitante de la velocidad a pH bajo.Se observó un efecto de viscosidad del solvente inverso en kcat/Km para NAD(P)H a pH neutro, mientras que se observó un efecto de viscosidad del solvente normal a pH más bajo.Juntos, los resultados indican un mecanismo único en el que se produce un cambio conformacional sensible al pH y limitante de la velocidad en la semireacción reductora, que afecta a la eficacia de la hidroxilación de la lisina.